Según una encuesta de CESIDA, las personas con el VIH estarían más dispuestas a vacunarse inmediatamente que la población general
Francesc Martínez – 21/12/2020 (gTt-VIH)
En las últimas fechas, diversos estados, entre los que se encuentran Estados Unidos, Reino Unido, Canadá, México, Costa Rica, Ecuador, Arabia Saudita, Israel, Singapur y Suiza han dado su aprobación por la vía de emergencia –a través de las agencias reguladoras competentes– a, como mínimo, una de las dos vacunas de desarrollo más avanzado frente al SARS-CoV-2, virus causante de la COVID-19 (acrónimo en inglés de enfermedad por coronavirus 2019). Hoy la Comisión Europea ha autorizado la comercialización de la vacuna de Pfizer y BioNTech y se espera que empiecen a utilizarse el día 27 de diciembre. Estas dos vacunas junto con la de Moderna y los NIH (Institutos Nacionales de Salud de EE UU, en sus siglas en inglés) son las más avanzadas en su desarrollo (véase La Noticia del Día 29/07/2020).
En las aprobaciones realizadas hasta la fecha, los paneles de expertos encargados han votado masivamente respecto a que los beneficios de la vacuna superan claramente a sus riesgos, por lo que la controversia que se observa en algunos entornos de la sociedad –probablemente producto de la desinformación o la notable falta de información facilitada por parte de las autoridades sanitarias a la población– no se observa en los expertos que cuentan con todos los datos clínicos de desarrollo de las vacunas. En ese sentido, algunos estados que ya han aprobado la vacuna han decidido hacer pública buena parte de los datos clínicos por motivos de transparencia. Ese es el caso de Canadá.
En España, conocemos a través de una encuesta realizada por la Coordinadora Estatal de ONG de VIH/Sida (CESIDA) que las personas con el VIH muestran una buena predisposición muestran una buena aceptación frente a la COVID-19. El sondeo incluye, además de variables clínicas y sociodemográficas, tres preguntas sobre la vacuna que el Centro de Investigaciones Sociológicas (CIS) formuló a los españoles en el barómetro del mes de noviembre.
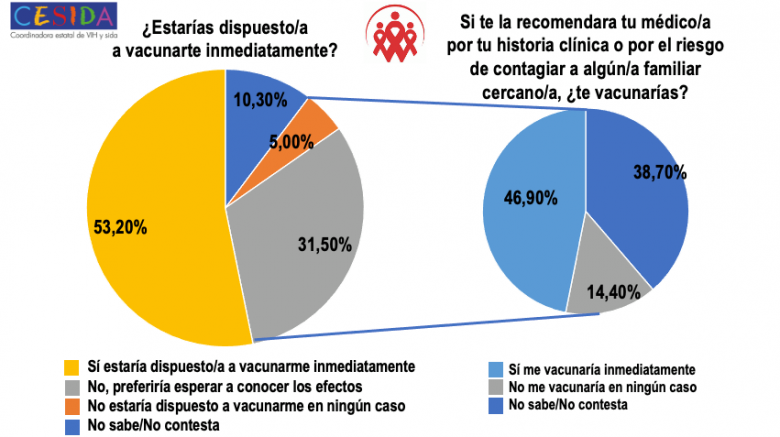
Los resultados preliminares de la encuesta de CESIDA muestran que un 53% de las personas con el VIH estarían dispuestas a vacunarse inmediatamente frente a la COVID-19 frente a un 31,5% que preferiría esperar a conocer los efectos de la vacuna y un 5,0% que no estarían dispuestos a vacunarse en ningún caso. Dichas tasas en la población general española fueron de un 32,5%, 55,2% y 8,4%, respectivamente.
A las personas con el VIH que respondieron que preferirían esperar a conocer los efectos y que no estarías dispuestos a vacunarse en ningún caso, se les preguntó si lo harían en el caso de que sus médicos se lo recomendasen por motivos clínicos (mayor vulnerabilidad) o por el riesgo de contagiar a algún familiar cercano. Los resultados muestran que, en esas circunstancias, un 46,9% sí se vacunaría inmediatamente y un 14,4% no lo haría en ningún caso, porcentaje que se mostró inferior al registrado en la población general (26,2%).
A pesar de esta buena aceptación, muchas personas con el VIH se preguntan si las vacunas son apropiadas para ellas y cuándo les tocaría acceder a ellas teniendo en cuenta las listas de priorización fijadas por sus países.
Las evidencias científicas actuales indican que la vacunación es segura en el colectivo de personas con el VIH y desde entornos comunitarios se está realizando presión para que sean un grupo poblacional convenientemente priorizado, especialmente teniendo en cuenta que son un grupo poblacional con más comorbilidades que la población general y que ello podría predisponer a un mayor riesgo de padecer COVID-19 grave (véase La Noticia del Día 07/09/2020).
También se ha observado un mayor riesgo en personas con el VIH y bajos niveles de CD4 (véase La Noticia del Día 28/09/2020). En el contexto español, dados los grupos definidos por las autoridades sanitarias, las personas con el VIH se encontrarían dentro del grupo con condiciones de riesgo, que sería el quinto en la cola de priorización tras residentes y personal sanitario y sociosanitario en residencias; personal sanitario en primera línea y resto del personal sanitario y sociosanitario; población mayor de 64 años y personas en situación de gran discapacidad.
Las vacunas frente a la COVID-19 se han desarrollado con una velocidad sin precedentes. A inicios de la pandemia se estimó que se tardarían entre 12 y 18 meses para desarrollar la vacuna, una previsión considerada altamente optimista pero que finalmente se ha incluso superado.
Dicha velocidad ha ido pareja a la difusión igualmente veloz de desinformación. Así, se publicaron artículos sugiriendo que las personas con el VIH deberían esperar a acceder a la vacuna por causa de potenciales aspectos de seguridad. La mayoría de expertos no están de acuerdo con este extremo. No hay ninguna razón para pensar que estas vacunas serán menos seguras para las personas con el VIH. La vacuna no puede provocar COVID-19 en la persona que la reciba ya que contienen solo un fragmento del virus sin capacidad de infectar (no contiene virus vivos, ni su material genético completo). No son vacunas vivas atenuadas lo que significa que se pueden utilizar en prácticamente cualquier persona que las necesite, incluso en aquellas con sistemas inmunitarios debilitados o problemas de salud a largo plazo.
No obstante, podría suceder que las personas con el VIH con recuentos muy bajos de CD4 –que serían uno de los grupos que más se beneficiaría de la vacunación frente a la COVID-19– no respondan tan bien a la vacuna lo que significa que podría desencadenar una respuesta más débil.
Tanto la vacuna de Pfizer y BioNTech como la de los NIH y Moderna emplean ARN mensajero (ARNm) encapsulado en nanopartículas lipídicas, que pueden entrar dentro de las células humanas tras la inyección de la vacuna. Dichas nanopartículas liberan el ARNm dentro de las células, que codifica una proteína de superficie del SARS-CoV-2 la cual, una vez liberada por la célula al espacio extracelular, desencadena una respuesta inmunitaria responsable de la inmunización. El ARNm se degrada rápidamente, por lo que no seguirá dentro del organismo por tiempos prolongados y tampoco se puede insertar en el ADN del núcleo celular. De todos modos, como solo codifica una proteína del virus no existe la posibilidad de que dicha proteína sea infectiva, ya que el virus necesita de otras proteínas para poder reproducirse y ser infectivo.
La estrategia probada en ambas vacunas se ha mostrado altamente eficaz. Así, la vacuna de Pfizer y BioNTech mostró una eficacia del 95% en la prevención de episodios de COVID-19 sintomática en un ensayo clínico de fase III que contó con la participación de 43.000 voluntarios. La vacuna de Moderna y los NIH, por su parte, en el ensayo clínico de fase III con unos 30.000 participantes mostró una eficacia del 94,1% para reducir la COVID-19 sintomática. Moderna presentó datos adicionales que indican que la eficacia de su vacuna para reducir casos asintomáticos sería de aproximadamente el 66%.
Ambos ensayos clínicos contaron con la participación de personas con infección por el VIH estable gracias al tratamiento antirretroviral. Desde entornos comunitarios se logró su inclusión tras presiones a Moderna para que cambiaran sus criterios de inclusión (que inicialmente excluían a personas con el VIH) y solicitar a Pfizer que aclarara si las personas con el VIH eran elegibles en su estudio.
El ensayo de Pfizer incluyó a 120 personas con el VIH (de las que solo una desarrolló COVID-19 sintomática y se encontraba en el grupo con placebo) y el de Moderna incluyó a 176 (de las que, como en el caso anterior solo una desarrolló COVID-19 sintomática y se encontraba en el grupo con placebo). No se reportaron problemas de seguridad inusuales con las vacunas entre los subgrupos de personas con el VIH.
Los ensayos clínicos de otras candidatas a vacuna frente a la COVID-19, tales como la de AStraZeneca y la Universidad de Oxford; la de Johnson & Johnson; la de Novarax y la de Sanofi/GlaxoSmithKline también incluyen a personas con el VIH en sus ensayos.
Aunque los números de participantes con el VIH han sido bajos, es muy probable que ambas vacunas se aprueben globalmente como indicadas para personas con el VIH. De hecho, en su aprobación de la vacuna de Pfizer, la Agencia de la Alimentación y el Medicamento de EE UU (FDA, en sus siglas en inglés) ha añadido a las personas con el VIH a sus indicaciones de uso.
En su ficha técnica de la vacuna de Pfizer, la FDA solicita que aquellas personas con inmunosupresión o que toman medicamentos inmunosupresores se lo hagan saber al profesional sanitario que les vaya a vacunar, pero los Centros para el Control y la Prevención de Enfermedades de EE UU (CDC) manifiestan que las personas inmunocomprometidas pueden recibir la vacuna si no existen contraindicaciones, pero informándoles siempre de que no se sabe a ciencia cierta la eficacia de la vacuna en personas de su perfil, ya que podría ser inferior a la de la población general.
En todo caso, una amplia mayoría de las personas con el VIH de los países occidentales –los únicos que accederán, de momento, a la vacuna frente a la COVID-19- presentan carga viral indetectable y buenos recuentos de células CD4, por lo que, aún con la incertidumbre existente, caben esperar buenos niveles de respuesta a la vacuna.
Otro aspecto positivo es que las vacunas de ARNm, dado que no contienen virus atenuado sino únicamente una proteína, no existe el riesgo de que la inmunosupresión genere algún riesgo de descontrol de la vacuna y aparición de COVID-19 que sí podría hipotéticamente darse en vacunas con virus atenuado.
Otras vacunas en desarrollo sí que presentan cierta controversia con relación al VIH, especialmente aquellas que utilizan como vector el adenovirus humano de tipo 5 (Ad5), ya que en un estudio con una candidata a vacuna del VIH, se observó que este vector podría incrementar el riesgo de adquisición del VIH en personas seronegativas. El uso del Ad5 se incluye en la vacuna desarrollada en China por CanSino Biologics y en la vacuna rusa Sputnik V. La vacuna de Oxford utiliza un adenovirus, pero es de chimpancé y en teoría no presentaría este problema.
Fuente: POZ / Grupo de Trabajo sobre Tratamientos del VIH (gTt-VIH).
Referencia: Comunicado de prensa de la FDA 11/12/2020.
Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020 Dec 10. doi: 10.1056/NEJMoa2034577. Epub ahead of print. PMID: 33301246.
Comunicado de prensa de la FDA 17/12/2020.
Buchbinder SP, McElrath MJ, Dieffenbach C, Corey L. Use of adenovirus type-5 vectored vaccines: a cautionary tale. Lancet. 2020 Oct 31;396(10260):e68-e69. doi: 10.1016/S0140-6736(20)32156-5. Epub 2020 Oct 19. PMID: 33091364; PMCID: PMC7571904.